HOME > 医療情報 > 各疾患・疾病・当院の取り組みについて > 低カリウム血症と高血圧
医療情報
内科:山北 宜由
低カリウム血症と高血圧症の合併は降圧利尿剤使用時に遭遇することが最も多いが、今回は、鉱質コルチコイド(MC)過剰あるいはMC作用の増強によるもの、更には、MC作用の増強と類似した病態ついて概説する。原発性アルドステロン(Ald)症
本症では副腎皮質からAldの過剰分泌が生じ、腎集合管でのNaの再吸収の増大に伴う循環血漿量の増加とKの尿中への排泄増加により、低K血症と高血圧をきたす。現在副腎の病理学的所見や遺伝子異常から9種類のサブタイプに分類されるが、古くから、副腎皮質腺腫によるもの(APA)、両側副腎皮質過形成(特発性Ald症IHA)、グルココルチコイド奏効性Ald症(GRA)の3者がよく知られている。Connは1955年の第一例目の報告後、高血圧患者の20%がAPAであるとしたが、その後の検討から、全高血圧患者の0.5%以下を占めるに過ぎない比較的稀な疾患とされてきた。
しかし、昨今のYoungやGordonらの報告では、原発性Ald症は、それぞれ全高血圧患者の20%、10%を占めるとされている。西川らの本邦人における報告でも6.4%を占めるとされており、更に、このうち低K血症を示したのは、わずか18%にしか過ぎず、低K血症だけを目安にしていては本症を見落とすとされるようになった。
また、CTでも直径6mm以下の副腎腺腫は描出されないことが多い。
 図1:原発性アルドステロン症における
図1:原発性アルドステロン症における
腎血管性高血圧症
腎動脈狭窄による腎動脈灌流圧の低下とそれによるレニン分泌の増加、尿細管中Na濃度の低下、アンギオテンシンII の増加、更にはAldの増加により、高血圧、低K血症が生ずる。本症の原因は、多岐にわたるが、ほぼ80~90%は動脈硬化性の内腔狭窄で、残り10~ 20%が線維筋性異形成によるものと考えてよい。しかし、おそらく、60歳以上の人の50%以上に腎血管病変は存在すると考えられるが、腎動脈内腔が30%以下にならないと高血圧を起こさないとする報告もあり、腎血管病変すなわち腎血管性高血圧症ではないことは留意すべきである。
腹部血管雑音、腎の左右差が1.5cm 以上ある場合、治療抵抗性の高血圧、急激な高血圧の悪化、等の臨床症状のある場合は、本症を疑わなければならない。また前述の機序により、低K血症を生じ得るが、10-20%程度の発症率であり、必発所見ではない。更に、過剰なレニン分泌があるとはいえ早朝空腹時のPRAが高値を呈するのは約50%程度とされている。カプトプリル50mgを投与してPRAの過大増加をみるのと同時に、その際レノグラムを撮影すると、狭窄側のレノグラムはより明確に異常を示し(図2)、スクリーニングに優れている。なお、カプトプリル負荷試験の場合、種々の診断基準が報告されているが、1例を挙げると、常食で投薬のない状態で、カプトプリル投薬1時間後のPRAが12ng/ml/h以上、かつ、前値より10ng/ml/h以上で150%以上の増加の際、陽性とする。現在、病歴から本症を疑った場合、以上の方法より、MR血管撮影や三次元CT(図3)での腎動脈狭窄の描出がより優れているとする意見もあるが、腎動脈分枝狭窄までの描出は直接造影検査が必要である。
治療に関しては、線維筋性異形成によるものでは、PTRAが良い成績を示す。動脈硬化性の腎動脈狭窄については、PTRA、外科的腎血管再建術、ACE阻害剤(ACE-I)、アンギオテンシン受容体拮抗剤(ARB)など、症例を選んで治療法を選択するが、どれが最も有効であるかは症例によって異なると思われる。特に、ACE-I、ARBにより急激に血圧低下、腎血流量低下を生じると、腎機能の急激な悪化が生じ、注意が必要で、他剤投与の方が良い場合がしばしばある。
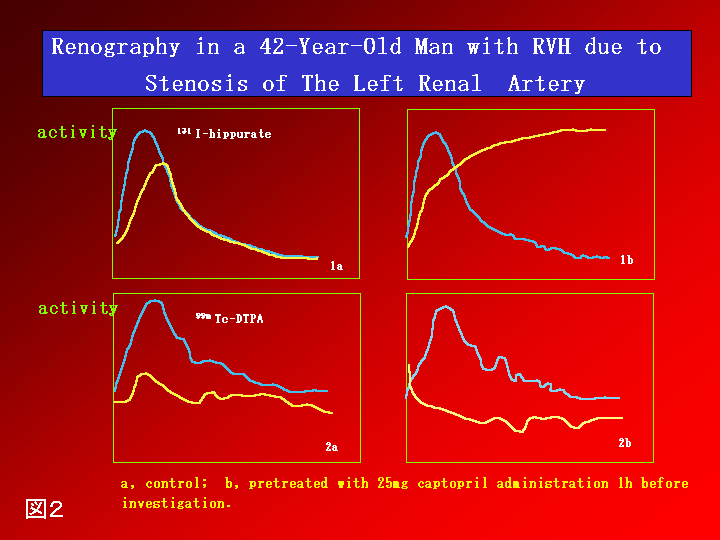 図2:Renography in a 42 Year-Old Man with RVH due to Stenosis of The Left Renal Artery
図2:Renography in a 42 Year-Old Man with RVH due to Stenosis of The Left Renal Artery
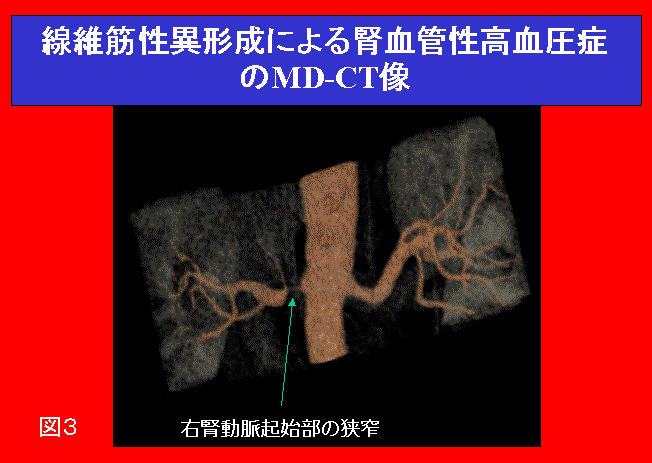 図3:線維筋性異形成による腎血管性高血圧症のMD-CT像
図3:線維筋性異形成による腎血管性高血圧症のMD-CT像
偽性Ald症
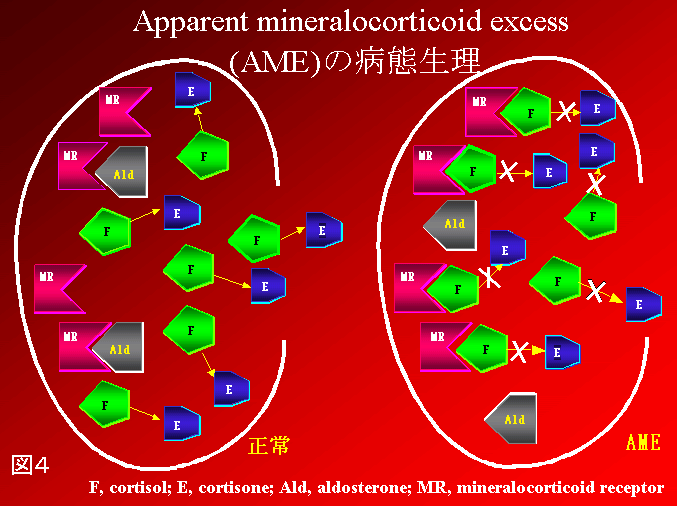 図4:Apparent mineralocorticoid excess
(AME)の病体生理
図4:Apparent mineralocorticoid excess
(AME)の病体生理
一方、上記2者以外に、常染色体性優性遺伝を示し、同様の症状を呈するLiddle症候群がある。Ald以外のMC過剰産生もなく当初Liddleは本症をpseudoaldosteronismと呼んだ。本症の治療には、MC受容体拮抗薬のスピロノラクトンは効果なく、腎尿細管上皮性Naチャンネル阻害剤であるトリアムテレンが有効である。Naチャンネルにはα、β、γのサブユニットがあるが正常のNa輸送にはα/βかα/γの作用が必要で、本症ではβあるいはγ遺伝子の突然変異が生じて、Naチャンネルが過剰活性を示している。このためNa 再吸収増加と循環血漿量増加による高血圧、低K血症、更に低レニン血性低Ald症が生じる(図5)(図6)。
以上は、日本内科学会北陸支部第29回生涯教育講演会(平成15年6月15日)における講演要旨をまとめたものである。)
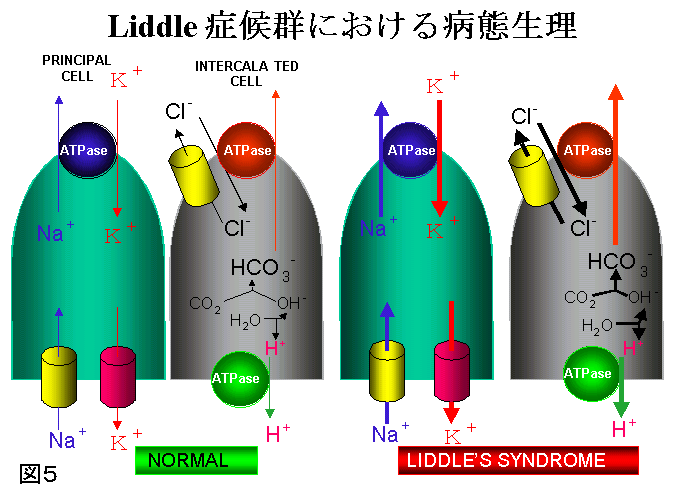 図5:Liddle症候群における病態生理
図5:Liddle症候群における病態生理
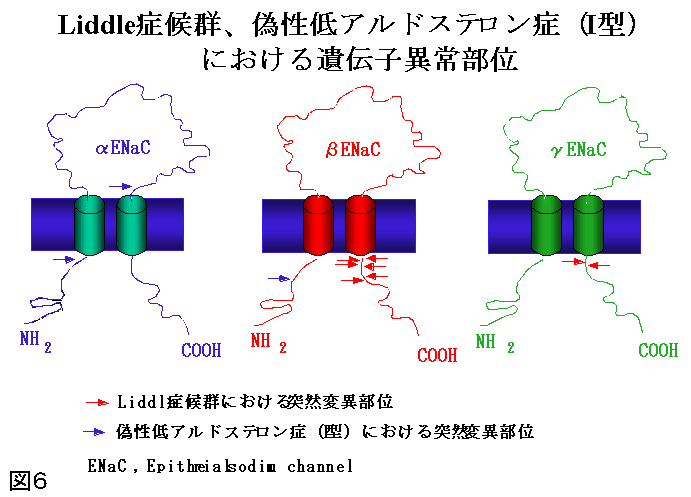 図6:Liddle症候群、偽性低アルドステロン症(I型)における遺伝子以上部位
図6:Liddle症候群、偽性低アルドステロン症(I型)における遺伝子以上部位
| 関連情報 | |
|---|---|
| 内科のご案内 | お問い合わせ |
医療情報
- 松波総合病院のチーム医療
- 病院の取り組み
- 医師コラム
-
薬剤師コラム「くすりの話」
- 薬を飲むタイミング
- お薬の保存方法
- 薬をお水で飲む理由
- お薬手帳について1
- 薬の飲み忘れについて
- スイッチOTC
- お酒とお薬について
- 貼り薬の種類について
- 「治す薬」と「管理する薬」
- お薬の副作用について
- お薬手帳について2
- 正しい目薬の使い方
- 妊婦さんの飲むお薬
- ジェネリック医薬品をご存知ですか?
- ステロイド外用剤を正しく使おう
- 軟膏・クリーム・ローションの違い
- 種類が増えました!インフルエンザの薬
- 花粉症のお薬について
- 入院時の持参薬の確認について
- 残ったお薬はどうしていますか?
- 薬のアレルギー
- 薬の「相互作用」について考えたことはありますか?
- 妊娠中や授乳中のステロイドの塗り薬の使用について
- インフルエンザの予防について
- 薬を飲む適切なタイミング
- エピペンをご存知ですか?
- 薬の意外な落とし穴
- 「赤い」液の目薬は着色しているの?
- 各制度についての情報
- 生活習慣病への対応について
-
各疾患・疾病・当院の取り組みについて
- 低カリウム血症と高血圧
- 鉱質コルチコイド受容体拮抗薬の心・腎保護作用
- 早期胃癌に対するESD
- 頸部内頸動脈狭窄症に対する頸動脈血栓内膜剥離術(CEA)
- 高血圧の話1
- 高血圧の話2
- 高血圧の話3
- 糖尿病の話1
- 糖尿病の話2
- 腱膜性眼瞼下垂と頭痛・肩こり
- 副腎偶発腫瘍の患者様へ
- くわしい乳癌のお話
- 乳腺疾患のお話
- 腹腔鏡下手術について
- 腹腔鏡下大腸切除術について
- バセドウ病(甲状腺機能亢進症)の放射性ヨード(アイソトープ)内服療法
- 単孔式腹腔鏡下手術について
- 反復性肩関節脱臼について
- 腱板断裂、肩峰下滑液包炎について
- 野球肘について
- 反転型(もしくは逆型)人工肩関節置換術(リバース型人工肩関節置換術)について
- 全人工膝関節置換術について
- 頸椎症性脊髄症、頸椎椎間板ヘルニア、頸椎後縦靭帯骨化症
- 腰椎椎間板ヘルニア
- 腰部脊柱管狭窄症、腰椎すべり症
- 骨粗鬆性脊椎圧迫骨折
- 脊椎外傷
- 単顆型人工膝関節置換術について
- 体外衝撃波疼痛治療 ドルニエ Epos Ultra
- 3Dテンプレートについて
- 頭痛、肩こりとまぶたのたるみ「眼瞼下垂」
- 広まる腹腔鏡下手術
- 頸動脈狭窄症の早期治療で脳梗塞を予防
- インフルエンザから子どもを守ろう!
- 増え続ける心筋梗塞を防ごう!
- 手術支援ロボット「ダ・ヴィンチ」講演会を開催
- 中高年女性に多い「骨盤臓器脱」
- がん患者会活動レポート『絆』
- 松波DMAT始動!!
- 大切な命を「子宮がん」から守ろう
- 慢性副鼻腔炎の内視鏡手術
- 腹部大動脈瘤の腹部ステントグラフトによる血管内治療実施施設
- 市民公開講座『からだ』に『やさしい』がん治療 ~手術ロボットの進歩~ を開催
- 透析合併症の予防と早期発見 その1「透析療法と心臓疾患」
- 透析合併症の予防と早期発見 その2「閉塞性動脈硬化症とフットケア」
- 手術で治る高血圧「原発性アルドステロン症」
- 介護老人保健施設の紹介 その1「“パーソン・センタード・ケア”に基づいた認知症ケア」
- 介護老人保健施設の紹介 その2 日常の健康管理について
- 「禁煙しよう!」と決めたら、今すぐ禁煙外来へ
- 乳房再建について
- コンタクトレンズと眼瞼下垂
- 各種検査の問診及び承諾書
- 松波総合病院
-
- 〒501-6062
岐阜県羽島郡笠松町田代185-1 
- 各施設へのお問い合わせはこちら
- 〒501-6062



















